Die Rolle der Linolsäure bei der Ceramidproduktion und der Gesundheit des Stratum Corneum
Linolsäure ist eine essenzielle Fettsäure, die für die Gesundheit der Haut eine wichtige Rolle spielt. Sie ist eine Vorstufe von Ceramiden, also Lipiden, die für die Bildung des Stratum corneum, der äußersten Schicht der Haut, unerlässlich sind. Das Stratum corneum fungiert als Barriere, die die Haut vor Umweltbelastungen schützt und den transepidermalen Wasserverlust (TEWL) verhindert. Die Lipide, die die extrazelluläre Matrix des Stratum corneum bilden, haben eine einzigartige Zusammensetzung und bestehen zu 50 % aus Ceramiden, zu 25 % aus Cholesterin und zu 15 % aus freien Fettsäuren (1). Ein Mangel an Linolsäure kann nicht nur zu einer unzureichenden Ceramidproduktion (2) führen, sondern auch zu all den anderen Symptomen, die mit einem Mangel an essenziellen Fettsäuren (EFA) verbunden sind, wie z. B. einer verminderten Barrierefunktion und anderen Hautproblemen (3-7).
Der folgende Text beschreibt den Mechanismus, durch den Linolsäure, wenn sie in Form eines Pflanzenöls auf die Haut aufgetragen wird, durch die Wirkung der in der Epidermis vorhandenen Enzyme in eine freie Fettsäure umgewandelt wird. In Form einer freien Fettsäure kann sie dann zu längerkettigen Fettsäuren weiterverarbeitet werden, die selbst biologische Funktionen haben oder als Bausteine für Ceramide verwendet werden können.
Fettsäuren und Triglyceride
Eine Fettsäure besteht aus einer Kette von Kohlenstoffatomen, an die entlang der Kette Wasserstoffatome gebunden sind, und an einem Ende der Kette befindet sich eine Carboxylgruppe. Diese Carboxylgruppe macht sie zu einer Säure. Von der Carboxylgruppe hat diese Klasse von Säuren ihren Namen: Carbonsäure.
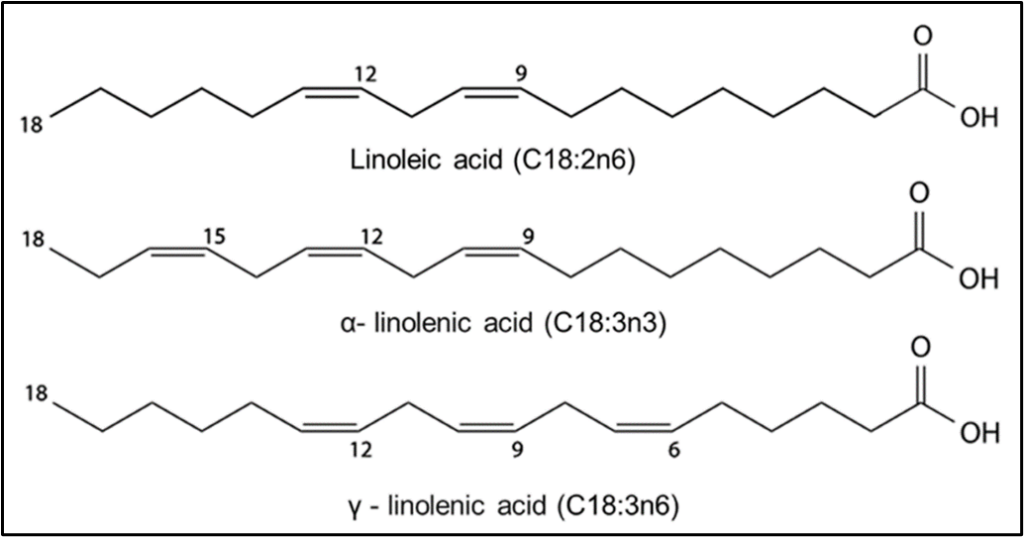
Abbildung 2 zeigt ein Bild von drei Fettsäuren, Linolsäure, Alpha-Linolensäure und Gamma-Linolensäure. In dieser Abbildung ist die 18 Kohlenstoffatome umfassende Kette mit Doppelbindungen an verschiedenen Positionen und einer Carboxylgruppe am rechten Ende der Kette zu sehen (8).
In Pflanzenölen sind die Fettsäuren mit einem Glycerinmolekül verbunden, um ein Triglycerid zu bilden. Ein Triglycerid besteht aus drei Fettsäuren, die an ein Glycerinmolekül gebunden sind.


Die Fettsäuren werden in Form von Triglyceriden in die Epidermis eingebracht, wenn eine Creme aufgetragen wird, die Pflanzenöle als Inhaltsstoffe hat.
Metabolismus von Pflanzenölen im Stratum Corneum
Damit die Zellen der Epidermis Linolsäure und andere Fettsäuren als Bausteine für ihre Stoffwechselprodukte verwenden können, muss das Triglycerid in seine Grundbestandteile Fettsäuren und Glycerin zerlegt werden. Der Prozess, bei dem ein Triglycerid in seine Fettsäurebestandteile zerlegt wird, heißt Lipolyse. Die Lipolyse ist ein mehrstufiger Prozess, der durch eine Reihe von Enzymen katalysiert wird. Die lipolytische Spaltung von TG findet in praktisch allen Zellen und Geweben des Körpers statt. In allen Zellen und Geweben werden die entstehenden Fettsäuren endogen zur Energiegewinnung oder für biosynthetische Prozesse genutzt (10).
Der erste Schritt der Lipolyse ist die Abspaltung einer Fettsäure aus dem Triglyceridmolekül. Dies geschieht durch das Enzym Adipose Triglycerid Lipase (ATGL). Das Ergebnis dieser Aktion ist ein Diacylglyceridmolekül und eine freie Fettsäure.
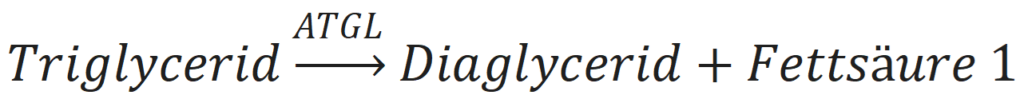
Der zweite Schritt der Lipolyse ist die Abspaltung einer weiteren Fettsäure aus dem Diacylglycerinmolekül. Dies geschieht mit Hilfe des Enzyms Hormonsensitive Lipase (HSL). Das Ergebnis dieser Reaktion ist ein Monoacylglycerinmolekül und eine zweite freie Fettsäure.

Der dritte und letzte Schritt der Lipolyse ist die Entfernung der letzten Fettsäure aus dem Monoglyceridmolekül. Dies geschieht durch das Enzym Monoglycerid-Lipase (MGL). Das Ergebnis dieser Reaktion ist ein Glycerinmolekül und eine dritte freie Fettsäure.

Alle drei Enzyme, die die Lipolyse katalysieren, sind in der Epidermis vorhanden. Die Lipolyse kann also in der Epidermis stattfinden, so dass die aus den Triglyceriden freigesetzten Fettsäuren von den Epidermiszellen genutzt werden können.
Freie Fettsäuren aus Triglyceriden als Bausteine für weitere Metabolite
Sowohl Linolsäure als auch Alpha-Linolensäure gehören zu den essenziellen Fettsäuren, was bedeutet, dass der Körper sie nicht selbst herstellen kann und sie von außen zugeführt werden müssen (11,12). Die freien Fettsäuren können im endoplasmatischen Retikulum der Zellen durch die dort vorhandenen Enzyme in längerkettige Fettsäuren umgewandelt werden (13-15). Die dabei entstehenden Metaboliten haben entweder selbst eine biologische Funktion oder können als Bausteine für noch komplexere Moleküle wie Sphingolipide und Ceramide verwendet werden (16-19).

1. Feingold KR, Elias PM. Role of lipids in the formation and maintenance of the cutaneous permeability barrier. Biochim Biophys Acta BBA – Mol Cell Biol Lipids. 1. März 2014;1841(3):280–94.
2. Costa A, Siqueira Talarico A, Parra Duarte C de O, Silva Pereira C, de Souza Weimann ET, Sabino de Matos L, u. a. Evaluation of the Quantitative and Qualitative Alterations in the Fatty Acid Contents of the Sebum of Patients with Inflammatory Acne during Treatment with Systemic Lymecycline and/or Oral Fatty Acid Supplementation. Dermatol Res Pract. 2013;2013:120475.
3. Skolnik P, Eaglstein WH, Ziboh VA. Human essential fatty acid deficiency: treatment by topical application of linoleic acid. Arch Dermatol. Juli 1977;113(7):939–41.
4. Yamamoto A, Serizawa S, Ito M, Sato Y. Stratum corneum lipid abnormalities in atopic dermatitis. Arch Dermatol Res. 1. April 1991;283(4):219–23.
5. Truchetet E, Brändle I, Grosshans E. Skin changes, pathophysiology and therapy in deficiency of essential fatty acids. Z Hautkr. 15. April 1988;63(4):290–301.
6. Prottey C, Hartop PJ, Press M. Correction of the Cutaneous Manifestations of Essential Fatty Acid Deficiency in Man by Application of Sunflower-Seed Oil to the Skin. J Invest Dermatol. 1. April 1975;64(4):228–34.
7. Jeppesen PB, Høy CE, Mortensen PB. Essential fatty acid deficiency in patients receiving home parenteral nutrition12. Am J Clin Nutr. 1. Juli 1998;68(1):126–33.
8. Islam MS, Christopher LP, Alam MN. Separation and Purification of ω-6 Linoleic Acid from Crude Tall Oil. Separations. März 2020;7(1):9.
9. de Alaiz A. What are Triglycerides? 2018 [zitiert 11. Oktober 2023]. clinidiabet.com > cardiodiabetes > What are Triglycerides? Verfügbar unter: https://clinidiabet.com/en/infodiabetes/cardiodiabetes/15.htm
10. Schweiger M, Eichmann TO, Taschler U, Zimmermann R, Zechner R, Lass A. Measurement of Lipolysis. Methods Enzymol. 2014;538:171–93.
11. Yuan Q, Xie F, Huang W, Hu M, Yan Q, Chen Z, u. a. The review of alpha-linolenic acid: Sources, metabolism, and pharmacology. Phytother Res. 2022;36(1):164–88.
12. Mogensen KM. Essential Fatty Acid Deficiency. Pract Gastroenterol. 2017;
13. Rabionet M, Gorgas K, Sandhoff R. Ceramide synthesis in the epidermis. Biochim Biophys Acta. März 2014;1841(3):422–34.
14. Jakobsson A, Westerberg R, Jacobsson A. Fatty acid elongases in mammals: their regulation and roles in metabolism. Prog Lipid Res. Mai 2006;45(3):237–49.
15. Moon YA, Horton JD. Identification of two mammalian reductases involved in the two-carbon fatty acyl elongation cascade. J Biol Chem. 28. Februar 2003;278(9):7335–43.
16. Gault C, Obeid L, Hannun Y. An overview of sphingolipid metabolism: from synthesis to breakdown. Adv Exp Med Biol. 2010;688:1–23.
17. Cha HJ, He C, Zhao H, Dong Y, An IS, An S. Intercellular and intracellular functions of ceramides and their metabolites in skin (Review). Int J Mol Med. 1. Juli 2016;38(1):16–22.
18. Murff HJ, Edwards TL. Endogenous Production of Long-Chain Polyunsaturated Fatty Acids and Metabolic Disease Risk. Curr Cardiovasc Risk Rep. 1. Dezember 2014;8(12):418.
19. Blaess M, Wenzel F, Csuk R, Deigner HP. Topical use of amitriptyline and linoleic acid to restore ceramide rheostat in atopic dermatitis lesions – a case report. Pharm. 1. September 2019;74(9):563–5.
20. Leng GC, Taylor GS, Lee AJ, Fowkes FG, Horrobin D. Essential fatty acids and cardiovascular disease: the Edinburgh Artery Study. Vasc Med Lond Engl. 1999;4(4):219–26.
