Unsere Seifen bieten wir nun schon eine Weile in 5er-Packs an. Da ist der Versand besonders ökonomisch (mit Warenpost) und wir geben dies als Preisvorteil an unsere Kunden weiter. Neu dabei ist, dass zwei der 5er-Packs nun aus gemischten Sets bestehen: eines enthält alle Besteller unserer Pflegeseifen und das andere alle unsere Kräuterseifen. Außerdem haben wir die Staffelpreise für unsere Seifen neu organisiert und auch reduziert: unsere Bestseller, sowie auch alle anderen 5er-Packs, bekommt man jetzt schon ab 19,50 EUR, Versand inklusive.
Blog
-

Heidelbeeren (Vaccinium Corymbosum) Blue Crop und Chandler
11.08.2022
Heidelbeeren sind bekanntlich eine sehr nahrhafte Beere und es bot sich die Gelegenheit, zwei weitere Sorten (Blue Crop und Chandler) zu einem sehr guten Preis zu erwerben…Lidl hatte sie für 3,99€ pro Pflanze im Angebot. Die Pflanzen waren nicht nur relativ preiswert, sondern es zeigte sich auch, dass an mehreren Ästen neues Wachstum vorhanden war. Es war also weiches Holz für Stecklinge vorhanden.


Abb. 1 Heidelbeersorten „Blue Crop“ (links) und „Chandler“ (rechts). 13.08.2022


Abb. 2 Stecklinge von „Blue Crop“ (links) und „Chandler“ (rechts). 
Abb. 3 Vier Stecklinge von „Blue Crop“ und sechs Stecklinge von „Chandler“ wurden entnommen und in angefeuchtetes Perlit gesetzt. 16.11.2022
Ungefähr 3 Monate sind vergangen, seit die Stecklinge in das Perlit gesetzt wurden. Sie wurden entfernt, die Wurzeln untersucht und in eine Mischung aus Erde und Perlit gesetzt.
Die Umpflanzung der Heidelbeere „Blue Crop“

Abb. 4 Heidelbeere „Blue crop“ nach etwa 3 Monaten in der Perlite. Beachten Sie die Feuchtigkeit, die auf dem Behälter sichtbar ist (die sich auf der Innenseite des Behälters befindet) und auch die Porosität des Mediums, in dem sich die Stecklinge befinden. Dies ist ein Vorteil der Verwendung von Perlit als Substrat für die Stecklingsvermehrung. Es hält die Feuchtigkeit sehr gut und bietet auch einen Zugang für Luft. Unter diesen Bedingungen werden die Stecklinge mit der nötigen Feuchtigkeit versorgt, aber sie werden nicht so schnell matschig.
Abbildung 5 zeigt die Stecklinge, nachdem sie aus dem Substrat entfernt worden sind. Einer der Stecklinge ist abgestorben. Bei den anderen drei noch lebenden Stecklingen scheint sich jedoch keine Wurzel zu entwickeln.

Abb. 5 Die vier „Blue Crop“-Stecklinge, die sich seit etwa 3 Monaten im Substrat befinden. Beachten Sie jedoch die Stelle, an der der Steckling von der Pflanze abgetrennt wurde. Dieser Bereich ist in einem vergrößerten Bild unten dargestellt. In diesem Bereich hat sich das Pflanzengewebe weiterentwickelt. Die Untersuchung der Stecklinge der Heidelbeeren „Chandler“ zeigt eine ähnliche Entwicklung und auch eine weitere Entwicklung.

Abb. 6 Vergrößerter Bereich des linken Stecklings in Abbildung 5, der die Entwicklung des Bereichs zeigt, in dem der Steckling vom Stamm abgetrennt wurde. Die drei verbleibenden Blue Crop“-Stecklinge wurden in eine Mischung aus Perlit, Gartenerde und Blumenerde gepflanzt.

Abb 7. Die drei verbleibenden „Blue Crop“-Stecklinge wurden am 13.08.22 entnommen und am 16.11.22 in eine Mischung aus Perlit, Gartenerde und Blumenerde gepflanzt. Heidelbeere „Chandler“
Von den sechs ursprünglichen Stecklingen der Blue berry Chandler überlebten vier und zeigten eine fortgeschrittenere Wurzelentwicklung. Die beiden, die nicht überlebt haben, waren vielleicht nicht tief genug im Perlit und vertrockneten.

Abb. 8 Die Stecklinge der Heidelbeere „Chandler“, die am 13.08.22 entnommen wurden. 
Abb. 9 Die 4 überlebenden Stecklinge der Chandler-Heidelbeere zeigen verschiedene Stadien der Wurzelentwicklung. Es ist zu erkennen, dass die beiden Stecklinge der Chandler-Heidelbeere auf der linken Seite in Abb. 9 eine viel weiter fortgeschrittene Wurzelentwicklung aufweisen als die Stecklinge auf der rechten Seite. Außerdem ist zu bemerken, dass der Steckling auf der rechten Seite, der sich in den Anfängen der Wurzelentwicklung befindet, die gleiche Form von Pflanzengewebe aufweist wie der Steckling von Blue Crop in den Abbildungen 5 und 6.

Abb. 10 Stecklinge der Heidelbeere „Chandler“ in einer Perlit-Erde-Mischung. Die vier Chandler-Stecklinge sowie ein weiterer, der im August von der Mutterpflanze abgebrochen und ebenfalls als Steckling behandelt wurde, wurden in eine Mischung aus Perlit, Gartenerde und Blumenerde gesetzt.
Bei der Betrachtung der Bilder der Wurzelentwicklung ist zu erkennen, dass die gesamte Wurzelentwicklung an der Stelle stattgefunden hat, an der die Stecklinge von der Mutterpflanze abgetrennt wurden. An den Blattknoten wurde keine Wurzelentwicklung festgestellt.
Dafür könnte es folgende Gründe geben:
1) Die Feuchtigkeit reichte nicht aus, um die Wurzelentwicklung weiter oben am Stamm zu fördern, wo sich die Blattknoten befanden.
2) An den Blattknoten war die Rinde nicht aufgebrochen, was die Wurzelentwicklung gefördert hätte.
3) Die Heidelbeerpflanze bildet ihre Wurzeln bevorzugt dort, wo der Stamm von der Mutterpflanze abgetrennt wird, und nicht an den Blattknoten.Bei der nächsten Entnahme von Stecklingen von Heidelbeerpflanzen werden diese Möglichkeiten in Betracht gezogen und die Stecklinge und das Substrat entsprechend konfiguriert, um die genannten Möglichkeiten zu testen.
-
Johannisbeere Titania (Ribes nigrum)
Die Beeren dieser Sorte schwarzer Johannisbeeren schienen süßer zu sein als die der Rosentahls Langtraubige. Dies stimmt mit der Werbung für die beiden Sträucher überein. Die Titania wurde als „süß-sauer“ und die Rosenthals Langtraubige als „sehr sauer“ beworben. Sie halten sich auch über drei Wochen im Kühlschrank.
Die Rosenthals Langtraubige wurde letzten Herbst durch Hartholzstecklinge vermehrt (von denen fünf überlebten), und die Titania wird jetzt vermehrt.

Abb.1 Johannisbeere Titania Mutterpflanze.

Abb. 2 Fünf Stecklinge wurden am 30.07.2022 aus der Mutterpflanze entnommen. Die Stecklinge wurden über Nacht in Wasser gelegt. Die Stecklinge wurden so beschnitten, dass sich mindestens drei Blattknoten unter dem Pflanzsubstrat befanden.

Abb.3 Der Stamm des Stecklings, der mit Perlit bedeckt werden sollte, wurde mit einem Bewurzelungsgel beschichtet, das das Bewurzelungshormon Indol-Buttersäure (IBA) enthielt.
01.08.2022 Von der Mutterpflanze wurden acht weitere Stecklinge entnommen.
16.08.2022

Abb. 4 Johannisbeere Titania Stecklinge, die am 31.07. entnommen wurden. Es ist zu beachten, dass das neue Wachstum zu sehen ist. Die älteren Blätter sind viel dunkler grün und/oder zeigen Anzeichen von Austrocknung.



Abb. 5 Johannisbeere Titania Stecklinge, die am 31.07. entnommen wurden. Auch an diesen Stecklingen ist neues Wachstum zu sehen. -

Süßkartoffeln (Ipomoea batatas)
Die Motivation für den Anbau von Süßkartoffeln besteht darin, das zerstörerische Verhalten des Kartoffelkäfers (Leptinotarsa decemlineata) zu vermeiden. Im Winter und zu Beginn des Frühjahrs wurden Versuche unternommen, Süßkartoffelpflanzen aus im Supermarkt gekauften Süßkartoffeln zu ziehen. Der Versuch war nur bedingt erfolgreich, und nur wenige Stecklinge schafften es ins Freiland. Diejenigen, die nicht von den Bewohnern des Feldes angegriffen wurden, schlugen keine Wurzeln und gingen zugrunde.
Eine Süßkartoffelpflanze konnte gerettet werden, nachdem sie von ihren Wurzeln getrennt worden war, und es wurden Stecklinge von der Rebe gemacht. Man hofft, dass die Stecklinge bewurzelt werden können und als Quelle für neue Pflanzen in der Saison 2023 dienen können. Bis zu dem Zeitpunkt, an dem die Süßkartoffelpflanze beschädigt wurde, ging es ihr auf dem Feld gut.

Abb. 1 23.07.2022 Stecklinge von Süßkartoffelreben, die von der letzten überlebenden beschädigten Pflanze im Anzuchtbeet entnommen wurden.

Abb. 2 Steckling der Süßkartoffelrebe im Wasser.
Während der ersten Wurzelbildung werden die Stecklinge der Süßkartoffelrebe auf einer Fensterbank aufbewahrt, die nicht direktes Sonnenlicht erhält.
27.07.2022
Nach drei Tagen im Wasser auf der Fensterbank wurde der Beginn der Wurzelbildung festgestellt. Drei Beispiele der 7 Stecklinge sind unten in Abb. 3 dargestellt.


Abb. 3 Drei Beispiele von Süßkartoffelstecklingen, die nach vier Tagen im Wasser eine Wurzelentwicklung aufweisen. Dass sich so schnell Wurzeln bilden, ist eine unerwartete Überraschung. Dieses Ergebnis legt auch nahe, dass es viel einfacher wäre, Stecklinge von einer Mutterpflanze zu vermehren, die über die Wintermonate gewachsen ist.
12.08.22
Sechs der sieben Stecklinge haben überlebt. Die beiden kleineren Stecklinge in dem Glas rechts in Abb. 2 haben eine robustere Wurzelentwicklung gezeigt als die Stecklinge in dem Glas auf der linken Seite.

Abb. 4. Süßkartoffelstecklinge aus dem rechten Glas in Abb. 2 nach siebzehn Tagen in Wasser. 

Abb. 5 Süßkartoffelstecklinge aus dem linken Glas in Abb. 2. Die Wurzelentwicklung ist nicht so weit fortgeschritten wie bei den Stecklingen in Abb. 4 aus dem linken Glas. Ein gemeinsames Element der vier Stecklinge in Abb. 5 ist, dass sie mehr älteres Wachstum (längere Stämme) aufweisen als die beiden Stecklinge in Abb.4. Außerdem wurde einige Tage nach dem Einsetzen der Stecklinge in das Wasser ein Geruch wahrgenommen, und das Wasser wurde viel schneller trüb als das kleinere Glas, was einen häufigeren Wasserwechsel erforderlich machte.
Als die Stecklinge nach siebzehn Tagen genauer untersucht wurden. Es zeigte sich, dass die Rinde aufgeweicht war und sich bei leichter Erschütterung vom Stamm löste. Die Zersetzung der Rinde könnte die Quelle für den beobachteten Geruch gewesen sein. Die Segmente der Stämme, die eine Zersetzung der Rinde aufwiesen, wurden von den Stecklingen entfernt.
13.08.2022

Abb. 6 Die Stecklinge A1 und A2 wurden in eine Mischung aus Gartenerde und Blumenerde gesetzt.
Die beiden Stecklinge mit fortgeschrittener Wurzelentwicklung (nennen wir sie A1 und A2) wurden in eine Mischung aus Gartenerde und Blumenerde gesetzt. Die Gartenerde enthält einheimische Mikroben und Pilze aus der Umgebung, in die sie gesetzt werden.
19.08.2022
Nach sieben Tagen ist zu erkennen, dass die drei Stecklinge, deren Stämme aufgrund der teilweisen Zersetzung gekürzt wurden, ein kräftiges Wurzelwachstum aufweisen. Zwei dieser Stecklinge sind bereit zum Einpflanzen in den Boden, nennen Sie sie B1 und B2. Der dritte Steckling wird weiter in kleinere Stecklinge unterteilt. Er kann als C bezeichnet werden und die Stecklinge daraus als C1-4.

12.08.2022 
19.08.2022 Abb. 7 Vergleich von B1 sieben Tage nach Entfernung des zersetzenden Stammabschnitts. 
12.08.2022 
19.08.2022 Abb. 8 Vergleich von B2 sieben Tage nach Entfernung des zersetzenden Stammabschnitts. 
12.08.2022 
19.08.2022 Abb. 9 Vergleich von C sieben Tage nach Entfernung des zersetzenden Stammabschnitts. 
Abb. 10 Steckling C aufgeteilt in 4 kleinere Stecklinge.
01.09.2022
Nur das mittlere Segment in der C-Gruppe der Stecklinge bildete keine Wurzeln aus. Der Steckling, der in der C-Gruppe nicht weiterwuchs, war der Steckling, der als zweiter von unten aus dem Hauptstamm entnommen wurde, wie in Abb. 10 dargestellt.

B1 01.09.2022 
B2 01.09.2022 Abb. 11 Stecklinge aus der B-Gruppe 01.09.2022. Die Wurzeln haben sich weiter entwickelt. 
01.09.2022 C1 vor dem Entfernen der Blätter 
01.09.2022 C1 nach dem Entfernen der Blätter Abb. 12 Steckling C1. Dies war das oberste Segment der C-Reihe. Die Blätter von Steckling C1 haben sich verfärbt und wurden entfernt. 
C2 01.09.2022 
C3 01.09.2022 Abb. 13 Der Steckling C2 wurde für die C-Serie aus dem untersten Teil der Rebe entnommen, und C3 ist der Neuaustrieb, der aus diesem unteren Teil hervorgegangen ist. Es ist zu erkennen, dass das unterste Segment der C-Serie die geringste Wurzelentwicklung aufwies. Das neue Wachstum, das sich aus diesem Abschnitt entwickelte, wurde jedoch zu einem eigenständigen Steckling, C3.
03.09.2022

A1 03.09.2022 
A2 03.09.2022 Abb.14 Anlagen A1 und A2 am 03.09.2022. Die Stecklinge A1 und A2, die am 13.08.2022 in Erde gesetzt wurden, haben sich gut entwickelt. Während der ca. 3 Wochen, die sie in der Erde verbracht haben, standen sie auf einem Balkon, der am späten Nachmittag Sonne abbekommen hat.


Abb. 15 Pflanzen B1 und B2 nach dem Umtopfen in Anzuchtbehälter. 


Abb. 16 Stecklinge in der C-Serie nach dem Umsetzen in die Anzuchtbehälter. 12.04.2023
In den Wintermonaten sind die Pflanzen der Serien B und C eingegangen. Die beiden Pflanzen der Serie A wuchsen in den Monaten mit kurzen Tagen und wenig Sonnenlicht langsamer, begannen aber mit der Tagundnachtgleiche ihr Wachstum zu beschleunigen.


Abb.17 Süßkartoffelpflanzen A1(Links) und A2 (Recht)
Von diesen beiden Pflanzen wurden Stecklinge entnommen.


Abb. 18 Stecklinge von Pflanze A1 (links) und A2 (rechts)
Und in Wasser gesetzt.


Abb. 19 Stecklinge von Pflanze A1 (links) und A2 (rechts) im Wasser
-

Erdbeere „Ostara“ (Fragaria x ananassa Ostara)
Die Erdbeersorte „Ostara“ ist eine immer tragende Sorte, deren Beeren zwischen Juli und November des Jahres zu finden sind.
Ich habe im Herbst 2019 einige Ostara-Erdbeerpflanzen im Angebot erworben und sie im darauffolgenden Frühjahr, als das Wetter es zuließ, angepflanzt. Obwohl die Pflanzen nur kleine Kronen waren, als ich sie erwarb, und sich in einem Zustand der Winterruhe befanden, der sie wie tot erscheinen ließ, trugen sie im ersten Jahr Früchte. Im Dezember 2021 hatten die Pflanzen das zweireihige Beet gut vermehrt.

Abb. 1 19.12.2021 Zweireihiges Beet mit Ostara-Erdbeeren. Die Pflanzen haben sich in den zwei Sommern, in denen sie angebaut wurden, sehr gut vermehrt.
Wie in Abb.1 zu sehen ist, haben die Pflanzen eine Dichte erreicht, bei der sie entfernt und geteilt werden müssen. Die Sanierung des Bettes wurde im Dezember 2021 begonnen. Die ausgewachsenen Pflanzen wurden entfernt und das Beet wurde erweitert, um drei Reihen Erdbeeren anzubauen.
Nach dem Entfernen der ausgewachsenen Pflanzen lässt sich der Wachstumsfortschritt erkennen. Was als eine kleine Krone im ruhenden Zustand begann, hat sich zu einer ziemlich großen Gemeinschaft von einzelnen Kronen entwickelt.

Abb. 2 Eine ausgewachsene Erdbeerpflanze, die aus dem Anzuchtbeet entfernt wurde.
Die Struktur der ausgewachsenen Erdbeerpflanzen kann man erkennen, wenn man die Erde entfernt und die Pflanze von unten untersucht.

Abb. 3: Die Wurzeln und die Kronen einer ausgewachsenen Erdbeerpflanze, wie man sie sieht, wenn die Erde entfernt wird.
Die ausgewachsenen Pflanzen können in einzelne Kronen geteilt werden, aus denen neue Erdbeerpflanzen hervorgehen. Von der Pflanze in Abb. 3 wurden 17 Kronen ausgeteilt, die neu gepflanzt werden können.

Abb. 4 Die ausgewachsene Erdbeerpflanze in Abb. 3 nach der Teilung in Kronen für die Neuanpflanzung.
Bei der Teilung der reifen Pflanzen und der Neubepflanzung der Kronen wurden drei Punkte beobachtet:
1) Die Erdbeerpflanzen sind recht widerstandsfähig und können den Teilungsprozess sehr gut überstehen.
2) Die ausgewachsenen Pflanzen können in recht kleine Kronen geteilt werden, aus denen dann neue Pflanzen hervorgehen. Viele der in Abb. 4 dargestellten Kronen könnten weiter aufgeteilt worden sein und hätten trotzdem neue Pflanzen hervorgebracht.
3) Eine reife Erdbeerpflanze kann in eine überraschend große Anzahl von Kronen geteilt werden, aus denen neue Pflanzen wachsen können. Die in Abb. 3 dargestellte Pflanze, von der die geteilten Kronen dargestellt sind, ist im Vergleich zu der Mehrzahl der aus dem Beet entfernten ausgewachsenen Pflanzen eine relativ kleine Pflanze. Es kann vermutet werden, dass diese Pflanze aus einem Ableger einer der ursprünglichen Kronen, die am Anfang des Beetes gepflanzt wurden, entstanden ist.Erweiterung des Bettes
Wie in Abb. 1 dargestellt, bestand das ursprüngliche Beet aus zwei Reihen. Es wurde auf drei Reihen mit einem Abstand von ca. 55 cm zwischen den Reihen und einem Abstand von 35 cm zwischen den Pflanzen verbreitert.

Abb. 5 Entfernen von ausgewachsenen Pflanzen und Ausweitung des Erdbeerbeetes. Oben auf dem Bild sind noch Reste der beiden ursprünglichen Reihen zu sehen, die noch nicht entfernt wurden.
Nachdem alle ausgewachsenen Pflanzen entfernt worden waren, wurde das Beet für die Bepflanzung mit den ausgeteilten Kronen vorbereitet. Die Zugabe von Kompost vor dem Einsetzen der Pflanzen wird von ihnen immer begrüßt.

Abb. 6 Das renovierte Beet mit drei Reihen von Erdbeerpflanzen. Die letzte Reihe der Pflanzen ist vor dem Mulchen mit Grasschnitt zu sehen.
Nach dem Einsetzen der Pflanzen wird das Beet gemulcht. In diesem Fall wurde Grasschnitt verwendet. Aufgrund des relativ großen Verhältnisses zwischen Feld und Beeten ist während der Vegetationsperiode frischer Grasschnitt verfügbar.
Das ursprüngliche Erdbeerbeet ist jetzt nur noch ein Erdbeerbeet im Projekt. Die überraschend große Menge an Kronen, die für die Anpflanzung neuer Pflanzen zur Verfügung standen, ermöglichte es, mehrere größere Erdbeerbeete anzulegen. Ein großer Teil der Pflanzen wurde verschenkt, weil nicht genügend vorbereitete Fläche für sie zur Verfügung stand.
11-12.06.2022
Die eingepflanzten Erdbeerpflanzen sind angewachsen und haben begonnen zu produzieren. Diese Pflanzen im vorderen Teil des Beetes wurden am 02.01.2022 eingepflanzt.


Abb. 7 Erdbeerbeet im Anzuchtbeet 1a: Links: Das Beet am 02.01. als die Pflanzen eingesetzt wurden. Rechts: Das Beet am 12.06. 
Abb. 8 Erdbeerpflanzen im Anzuchtbeet 1a, die am 02.01.2022 gesetzt wurden.
Wie in Abb. 8 zu sehen ist, haben die Erdbeerpflanzen, die am 02.01. geflanzt wurden, Früchte getragen. Die Beeren sind kleiner als bei den ausgewachsenen Pflanzen, die im letzten Jahr vor der Teilung produziert wurden. Wenn man jedoch bedenkt, dass die Pflanzen etwas mehr als 5 Monate alt sind und sich vom Teilungsprozess erholen mussten, sind die Ergebnisse nicht schlecht.
Nachdem die Beeren geerntet waren, wurde das Unkraut, das durch die Mulchdecke hindurchgewachsen war, entfernt und eine weitere Schicht Grasschnitt aufgebracht. Die anderen Erdbeerpflanzen wurden ähnlich behandelt.

Abb. 9 Erdbeerpflanzen im Beet 1a nach dem Aufbringen einer zusätzlichen Schicht von Grasschnitt.
Die Erdbeersorte „Ostara“ ist eine Erdbeersorte, die zweimal im Jahr Beeren tragen kann. Wenn alles gut geht, kann man im Herbst mit einer zweiten Beerenernte rechnen.
16.07.2022
Die Sorte „Ostara“ ist als „ewig tragend“ bekannt, und man kann sehen, warum dieser Name für diese Sorte angemessen ist. Am 16. Juli tragen die Pflanzen reife Erdbeeren, und es ist auch zu sehen, dass Blüten und unreife Beeren vorhanden sind. Diese Eigenschaft ist wünschenswert, wenn man eine Pflanzensammlung anlegen möchte, die während der gesamten Vegetationsperiode einen kontinuierlichen Nachschub an Beeren liefert.

Abb. 10 Ostara-Erdbeeren am 16. Juli. Beachten, daß nicht nur reife Beeren vorhanden sind, sondern auch grüne Beeren und Blüten.

Abb. 11 Außerdem sind an den Ausläufern einiger Pflanzen, die im zeitigen Frühjahr ins Beet gesetzt wurden, Erdbeeren und Blüten zu sehen. Die Pflanze in Abb. 11 ist eine besonders motivierte Pflanze, die sich schneller vermehrt als die meisten anderen Pflanzen. -

Die ultra-scharfen Chilis, Capsicum Chinense
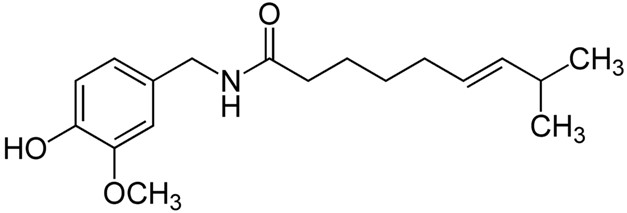
Die schärfsten Chilis der Welt gehören zu den Chinense Art. Für Fans von ultrascharfen Chilis geht es beim Anbau hauptsächlich um das unten abgebildete Molekül Capsaicin und darum, wie man möglichst viel davon in der produzierten Chilischote konzentrieren kann.

Abb. 1 Struktur des Capsaicinmoleküls Die Fähigkeit der Pflanze, Capsaicin in ihren Früchten zu konzentrieren, hängt von der Sorte der jeweiligen Art ab. Es wurde eine Skala entwickelt, um die Schärfe (die Capsaicin-Konzentration) der Chili-Früchte zu bewerten. Die Maßeinheit in dieser Skala ist die Scoville Heat Unit.
In Abbildung 2 sind die SHU-Werte verschiedener Chilisorten aufgeführt.

Abb. 2 Schovill heat unit Werte für verschiedener Chilisorten In der Anbausaison 2022 werden die folgenden 5 Chilis, die in Tabelle 1 aufgeführt sind, angebaut.
Chili Scoville Heat Units (SHU) Carolina Reaper 1.569.300-2.2 Mio. Trinidad Scorpion Moruga 1.207.764-2 Mio. 7 Pot Brainstrain Yellow ca. 1 Mio. Bhut Jolokia Caramel ca. 500.000 Habanero Big White ca. 300.000 Tabelle 1. Die Ultra-Hot-Chili-Varietäten, die in der Saison 2022 angebaut werden Darüber hinaus konnte eine Chili-Pflanze aus der Anbausaison 2021 überwintert werden. Eine 7-Topf Chaguanas Chocolate (800.000-1 Mio. SHU).

Abb. 3 28.01.2022 Eine 7 Pot Chaguanas Chocolate Chilli pflanze aus der 2021 Season, das Überwintert hatte. Die ersten Fröste der Saison 2021 haben die anderen Chilis so geschädigt, dass sie nicht erfolgreich überwintert werden konnten.
Keimung der Chilisamen für 2022
23.01.22 Die zu keimenden Samen wurden in ein feuchtes Papiertuch eingewickelt, in eine Plastiktüte gelegt und auf die Wärmematte des Inkubators gestellt (Abb. 4).



Abb. 4 Inkubationseinrichtung für Chilisamen Die Temperatur wurde mit einem Inkbird ITC-306 Temperaturregler geregelt, der auf 27°C mit einer Temperaturdifferenz von 0,4°C eingestellt war. Das Temperaturprofil des Inkubators wurde mit einem K-Typ-Thermoelement gemessen, das an einen Datenlogger (Lascar Electronics) angeschlossen war, der eine Temperaturmessung in Intervallen von einer Minute aufzeichnete. Ein repräsentativer Abschnitt der Heizzyklen ist in Abb. 5 dargestellt. Dieses Datensegment zeigt den Heizzyklus, nachdem der Inkubator 300 Minuten lang in Betrieb gewesen war.

Abb.5 Heizzyklus des Inkubators nach 300 Minuten Betrieb. 27.01.2022
Die ersten ultra-scharfen Chilisamen, die gekeimt sind, waren die Carolina Reaper. Acht von zehn Samen waren bereit, in die Erde gebracht zu werden.

Abb. 6 Carolina Reaper Samen nach etwa 4 Tagen im Inkubator. 
Abb. 7 31.01.2022 Nach etwa drei Tagen beginnen die ersten Carolina-Reaper-Pflanzen durch den Boden zu stoßen. Die Pflanzen standen in einer durchsichtigen Plastikbox auf einer Fensterbank. Der Raum, in dem sie standen, war nicht beheizt, lag aber neben beheizten Räumen.

Abb. 8 Carolina Reaper Pflanzen am 17.03.2022 Die Wachstumsrate der Carolina Reaper-Pflanzen ist relativ langsam. Dies ist auf die Temperatur- und Lichtbedingungen zurückzuführen, unter denen die Pflanzen gewachsen sind.