Inhalt:
- Einleitung
- Hintergrund
- Forschung
- Produktionsmethode
- Schlussfolgerung
- Referenzen
Einleitung
Die Verwendung von Johanniskraut (SJW) (Hypericum perforatum) als Heilpflanze lässt sich bis zu den alten Griechen zurückverfolgen. In der gesamten Antike und bis ins Mittelalter hinein wurde auf seine medizinischen und (vermutlich) magischen Kräfte verwiesen. Es taucht in den Schriften englischer Kräuterkundler um 1600 auf, und sein Mazerat, Oleum Hyperici, ist im ersten Londoner Arzneibuch aufgeführt [1]. Dieses Mazerat ist Gegenstand des Interesses und wird aus den Johanniskrautpflanzen hergestellt, die im Permakultur-Versuchsgebiet wachsen.
Hypericum perforatum ist eine sehr gut untersuchte Heilpflanze. Von Interesse ist seine Fähigkeit, die Symptome von Erkrankungen wie Dermatitis, Psoriasis und anderen Zuständen zu lindern, die zu trockener, gereizter Haut führen. Die entzündungshemmenden, antimikrobiellen, antiviralen und wundheilenden Eigenschaften von SJW wurden von vielen Forschern untersucht, und seine Fähigkeit, Reizungen der Epidermis zu lindern, wurde in vielen Studien bestätigt [2-9].
Hintergrundforschung
Das Mazerat Oleum Hyperici wird aus den frischen oder getrockneten blühenden Teilen der SJW-Pflanze hergestellt. Die Verwendung eines lipophilen Lösungsmittels im Extraktionsprozess begünstigt die Extraktion des Phloroglucinol-Hyperforins und des Naphthodianthrons Hypericin [5]. Diese Verbindungen sind in Abb. 1 unten dargestellt.


Heinrich et al. untersuchten die Auswirkung verschiedener Beleuchtungs- und Temperaturkombinationen auf die Konzentration bioaktiver Komponenten von SJW-Mazeraten, die eine Extraktionszeit von 28 Tagen hatten [10]. In einer weiteren Studie wurden die Extraktionseigenschaften von 12 verschiedenen fetten Ölen auf die in SJW vorhandenen Phytochemikalien untersucht [11]. Die Ergebnisse ihrer Untersuchung dieser Faktoren ergaben die folgenden Ergebnisse, die in den folgenden Grafiken aus den Zeitschriftenartikeln dargestellt sind:

Abb. 2 Vergleich der Hyperforin- und Adhyperforinkonzentrationen von SJW-Mazerat, das unter verschiedenen Temperatur- und Lichtbedingungen hergestellt wurde. D – Dunkel, AL – Kunstlicht, SL – Sonnenlicht. Es ist zu erkennen, dass die Hyperforin- und Adhyperforinkonzentrationen des Mazerats durch Lichteinwirkung negativ beeinflusst werden und bei Raumtemperatur am besten extrahiert werden können [10].

Abb. 3 Vergleich der Hyperforin- und Adhyperforin-Konzentrationen von SJW-Mazerat, das unter verschiedenen Temperatur- und Lichtbedingungen hergestellt wurde. D – Dunkel, AL – Kunstlicht, SL – Sonnenlicht. Es ist ersichtlich, dass die Hyperforin- und Adhyperforin-Konzentrationen des Mazerats durch Lichteinwirkung negativ beeinflusst werden und bei Raumtemperatur am besten extrahiert werden können [10].
In Abb. 4 unten sind die Ergebnisse des Experiments von Heinrich et al. zu den Extraktionseigenschaften von 12 verschiedenen Fettölen dargestellt. Die Extraktion wurde bei 50 °C über einen Zeitraum von 7 Tagen durchgeführt. Die Lichtverhältnisse während des Extraktionsprozesses wurden nicht angegeben.

Abb. 4 Grafik A zeigt einen Vergleich der Hyperforin- und Adhyperforinkonzentrationen von SJW-Mazeraten unter Verwendung verschiedener Fettöle. Unter den gegebenen Bedingungen ist zu erkennen, dass Macadamianussöl (I´) die höchste Konzentration an Hyperforin (36,7 mg/100 g) und Adhyperforin (4,6 mg/100 g) aufwies, etwa das 2,4-Fache der Konzentration der traditionell verwendeten Olivenölprobe J‘ (15 bzw. 2 mg/100 g).
Grafik B zeigt die gemessenen Konzentrationen von Flavonoiden, die auch in jedem Mazerationsöl nachgewiesen wurden [11].

Abb. 5 Vergleich der Hypericin-Konzentration von SJW-Mazeraten unter Verwendung verschiedener Fettöle. Unter den gegebenen Bedingungen ist zu erkennen, dass die Mandelölprobe E´ mit Abstand die höchste Hypericin-Konzentration aufwies (ca. 5,6 mg/100 g) [11].
Aus diesen Ergebnissen lässt sich erkennen, dass alle Mazerate in unterschiedlichen Konzentrationen eine Mischung aus Hyperforin, Adhyperforin, Hypericin und Flavonoiden enthalten. Die Bedeutung dieser Ergebnisse für die Herstellung von SJW-Öl wird von den Autoren des Fachartikel sehr gut zum Ausdruck gebracht:
„Wie aus den oben genannten Ergebnissen abgeleitet werden kann, erreichte keines der getesteten fetten Öle maximale Ausbeuten aller untersuchten Zielverbindungen. Vielmehr müssen, wie in der vorliegenden Studie bewertet, die für die SJW-Extraktion verwendeten Lösungsmittel sorgfältig entsprechend den therapeutischen Anforderungen der resultierenden Extrakte ausgewählt werden.“ [11]
Unter Berücksichtigung der Ergebnisse von Heinrich et al. wurden für die ersten Extraktionsversuche zur Herstellung von Oleum Hyperici folgende Lösungsmittel und Parameter ausgewählt:
Mandelöl wird als Lösungsmittel verwendet, und die Extraktion erfolgt unter lichtgeschützten Bedingungen bei einer Temperatur von 40 °C. Diese Wahl der Parameter und des Lösungsmittels schafft Bedingungen, die sowohl für Hypericin und Hyperforin als auch für die Flavonoide günstig sind. Zum Vergleich wird Mandelöl als Lösungsmittel verwendet, und der transparente Glasbehälter mit der Mazerationsmischung wird auf die Fensterbank gestellt und bei Raumtemperatur gelagert.
Die Herstellung von Oleum Hyperici
Es gibt viele Arten von Hypercum. Um festzustellen, ob es sich bei der betreffenden Pflanze um die Art preforatum handelt, gibt es drei Unterscheidungsmerkmale, die ihre Identität bestätigen. Diese Merkmale sind in Abb. 6 unten beschrieben.
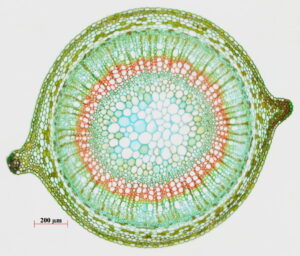
1) Der Schaft ist kreisförmig mit zwei Vorsprüngen, die um 180° zueinander versetzt sind.

2) Die Blüten sind leuchtend gelb, haben fünf Blütenblätter und aus der Mitte strahlende Septen. Wenn man die Blüten zwischen den Fingern reibt, färbt sich die Haut durch die Sekundärmetaboliten dunkelrot.

3) Wenn die Blätter gegen das Licht gehalten werden, sind die Poren sichtbar und es sieht aus, als wären die Blätter perforiert.
Abb. 6 Merkmale von Hypercum preforatum (Fotos WIKI Commons)

Abb. 7 Johanniskraut-Blüten wurden im Permakulturprojekt in der Nähe von Meißen, Deutschland, geerntet.

Abb. 8 Die geernteten Johanniskraut-Blüten werden gereinigt und kontrolliert.
Um die mazerierten Proben vor Licht zu schützen und sie gemäß der Beschreibung von Heinrich et al. [10] bei einer Temperatur von 40 °C zu halten, wurde ein Isolierbehälter aus einer Styropor-Isolierplatte konstruiert und eine Pflanzenwärmematte als Wärmequelle darin platziert (Abb. 9). Die Temperatur im Inneren des Behälters wurde durch Anpassen der Öffnungsweite an die gewünschte Temperatur reguliert. Zur Messung und Aufzeichnung der Temperatur im Inneren des Behälters wurde ein Datenlogger verwendet.


Nach Ablauf der gewünschten Mazerationszeit wird das Öl durch ein Sieb geleitet, um zunächst die größeren Pflanzenreste abzutrennen, und anschließend durch einen Filter mit einer Maschenweite von 300 (48 Mikrometer). Die abschließende Filterung erfolgt mit einem Vakuumfiltersystem unter Verwendung des in Abb. 10 abgebildeten Filterpapiers.


In Abb. 11 unten ist eine Probe des gefilterten Öls dargestellt. Das Filterpapier im Vakuumfiltersystem entfernt Material, das den 300-Maschen-Filter passiert hat, und liefert ein klares Produkt.

Es wurde ein Vergleich zwischen den Mazerationsbedingungen bei Dunkelheit und 40 °C und bei Raumtemperatur und der herkömmlichen Methode, bei der der Behälter auf einer Fensterbank in die Sonne gestellt wurde, durchgeführt. Die Ergebnisse dieses Vergleichs sind in Abb. 12 unten dargestellt.



Wie aus dem Vergleich der gefilterten Öle ersichtlich ist, weist die Extraktion, die im Dunkeln bei 40 °C durchgeführt wurde, eine tiefere rote Farbe auf und weist somit auf eine höhere Konzentration an sekundären Metaboliten hin als die Probe, die auf der Fensterbank im Sonnenlicht extrahiert wurde. Dies steht im Einklang mit den Ergebnissen von Heinrich et al. [10] und auch mit den beobachteten Phänomenen, dass die Löslichkeit eines gelösten Stoffes oft direkt proportional zur Temperatur ist.
Schlussfolgerungen
Die Herstellung von Johanniskrautöl unter Ausschluss von Licht und bei 40 °C ist sichtbar effizienter als die traditionelle Herstellungsmethode.
Eine Vakuumfilterung ist erforderlich, um die verbleibenden Pflanzenreste zu entfernen, die einen handelsüblichen 300-Mesh-Nylonfilter passiert haben.
Referenzen
1) Hobbs, C. “St. John’s wort–ancient herbal protector.” Pharmacy in history vol. 32,4 (1990): 166-9.
2) Prisăcaru, Anca Irina et al. “Evaluation of the wound-healing effect of a novel Hypericum perforatum ointment in skin injury.” Romanian journal of morphology and embryology vol. 54,4 (2013): 1053-9.
3) Birt, Diane F et al. “Hypericum in infection: Identification of anti-viral and anti-inflammatory constituents.” Pharmaceutical biology vol. 47,8 (2009): 774-782.
4) Okmen G, Balpınar N. THE BIOLOGICAL ACTIVITIES OF HYPERICUM PERFORATUM L. Afr J Tradit Complement Altern Med. 2016 Nov 23;14(1):213-218.
5) Wölfle, Ute et al. “Topical application of St. John’s wort (Hypericum perforatum).” Planta medica vol. 80,2-3 (2014): 109-20.
6) Mansouri, P et al. “The impact of topical Saint John’s Wort (Hypericum perforatum) treatment on tissue tumor necrosis factor-alpha levels in plaque-type psoriasis: A pilot study.” Journal of postgraduate medicine vol. 63,4 (2017): 215-220.
7) Barnes, J et al. “St John’s wort (Hypericum perforatum L.): a review of its chemistry, pharmacology and clinical properties.” The Journal of pharmacy and pharmacology vol. 53,5 (2001): 583-600.
8) Lyles, James T et al.“The Chemical and Antibacterial Evaluation of St. John’s Wort Oil Macerates Used in Kosovar Traditional Medicine” Frontiers in microbiology vol. 8 1639. 8 Sep. 2017
9) Silva, Ana R et al. “Hypericum genus cosmeceutical application – A decade comprehensive review on its multifunctional biological properties” Industrial Crops and Products vol. 159 Jan. 2021, 113053
10) Heinrich, M et al. “Comprehensive phytochemical characterization of St. John’s wort (Hypericum perforatum L.) oil macerates obtained by different extraction protocols via analytical tools applicable in routine control” Die Pharmazie vol. 72,3 (2017): 131-138.
11) Heinrich, M. et al. “Characterization of Hypericum perforatum L. (St. John’s wort) macerates prepared with different fatty oils upon processing and storage” Phytochemistry Letters Vol. 20, June 2017, Pages 470-480
