Die Weinrebe, die zufällig in der Nähe des Eingangs zu unserer Wohnung wächst, produziert köstliche Trauben. Mehr von diesen Trauben sind wünschenswert und aus diesem Grund wurde versucht, sie durch Stecklinge zu vermehren.

Der Herbstschnitt hat sehr viel Material für Stecklinge geliefert. Die entnommenen Äste wurden untersucht und auf eine für die Stecklingsvermehrung geeignete Größe zugeschnitten. Die Stecklinge wurden in Behälter gelegt, die den unteren Teil des Stängels mit Wasser bedecken. Die Behälter wurden in einem ungeheizten Raum in der Wohnung aufgestellt und vor direkter Sonneneinstrahlung geschützt.
09.01.2023
Zu Beginn der zweiten Januarwoche wurden die Stecklinge kontrolliert. Es wurde festgestellt, dass einige der motivierteren Stecklinge begannen, Wurzeln und Triebe zu bilden.



Abb. 2. Stecklinge von Weinreben am 09.01.23 mit den Anfängen der Wurzelbildung und dem Austreiben der Blätter.
Die am weitesten fortgeschrittenen Stecklinge wurden in Erde gepflanzt, während die Stecklinge, die keine nennenswerte Wachstumsaktivität zeigten, im Wasser belassen wurden.



Abb. 3 09.01.2023 Die weiter fortgeschrittenen Stecklinge im Boden und die weniger oder gar nicht aktiven Stecklinge im Wasser.
11.02.2023
Die in den Boden eingepflanzten Stecklinge haben begonnen, Blätter zu entwickeln (Abb. 4 Unten). Die Pflanzen mit den stärker entwickelten Blättern standen auf einer Fensterbank, die wärmer war und mehr direktes Sonnenlicht hatte. Die Pflanzen in der Plastikschale (Abb. 4 Rechts) standen aus Platzmangel in einem ungeheizten Raum, der zwar sonnig war, aber kein direktes Sonnenlicht abbekam.



Abb. 4 Die Stecklinge, die am 09.01.2023 in den Boden eingebracht wurden. 11.02.2023
Die weniger fortgeschrittenen Stecklinge (Abb. 5), die im Wasser belassen wurden, befanden sich an einem kühleren Ort ohne direkte Sonneneinstrahlung.


Abb. 5 Stecklinge, die am 09.01.2023 noch keine nennenswerte Wurzelentwicklung gezeigt hatten, wurden wieder in den Behälter gelegt, wobei das untere Ende im Wasser stand. 11.02.2023
Die Stecklinge wurden untersucht und ihre Entwicklung notiert. Es wurde festgestellt, dass die Wurzelentwicklung bei fast allen Stecklingen fortgeschritten ist. Einige der bemerkenswertesten Stecklinge sind unten aufgeführt.

Abb. 6 Der Steckling auf der linken Seite hat die am weitesten fort-geschrittene Wurzelentwicklung. Achten Sie auf die Position der beiden Blattknoten und darauf, dass zwischen ihnen eine Wurzel-entwicklung zu erkennen ist. Dieses Ergebnis ist auch bei anderen Stecklingen zu beobachten.



Abb. 8 Fläche zwischen den Blattknoten von Stecklingen, die in Wasser gelegt waren.
Bei den oben in Abb. 6-8 gezeigten Stecklingen fällt auf, dass die Anordnung der Blattknoten enger ist als bei anderen Stecklingen. Außerdem ist zu erkennen, dass sich die Wurzeln nicht nur an den Blattknoten, sondern auch in der Region zwischen den Blattknoten entwickeln.
Noch deutlicher wird das Phänomen beim Vergleich zwischen zwei Stecklingen, bei denen die Blattknotenabstände in größerem Maße variieren. Dies ist in Abb. 9 zu sehen. Der linke Steckling hat größere Abstände zwischen den Blattknoten. Es ist zu erkennen, dass dort die Wurzelentwicklung an beiden Knoten begonnen hat, der Bereich zwischen den Knoten zeigt jedoch keine erkennbaren Anzeichen für eine Wurzelentwicklung.
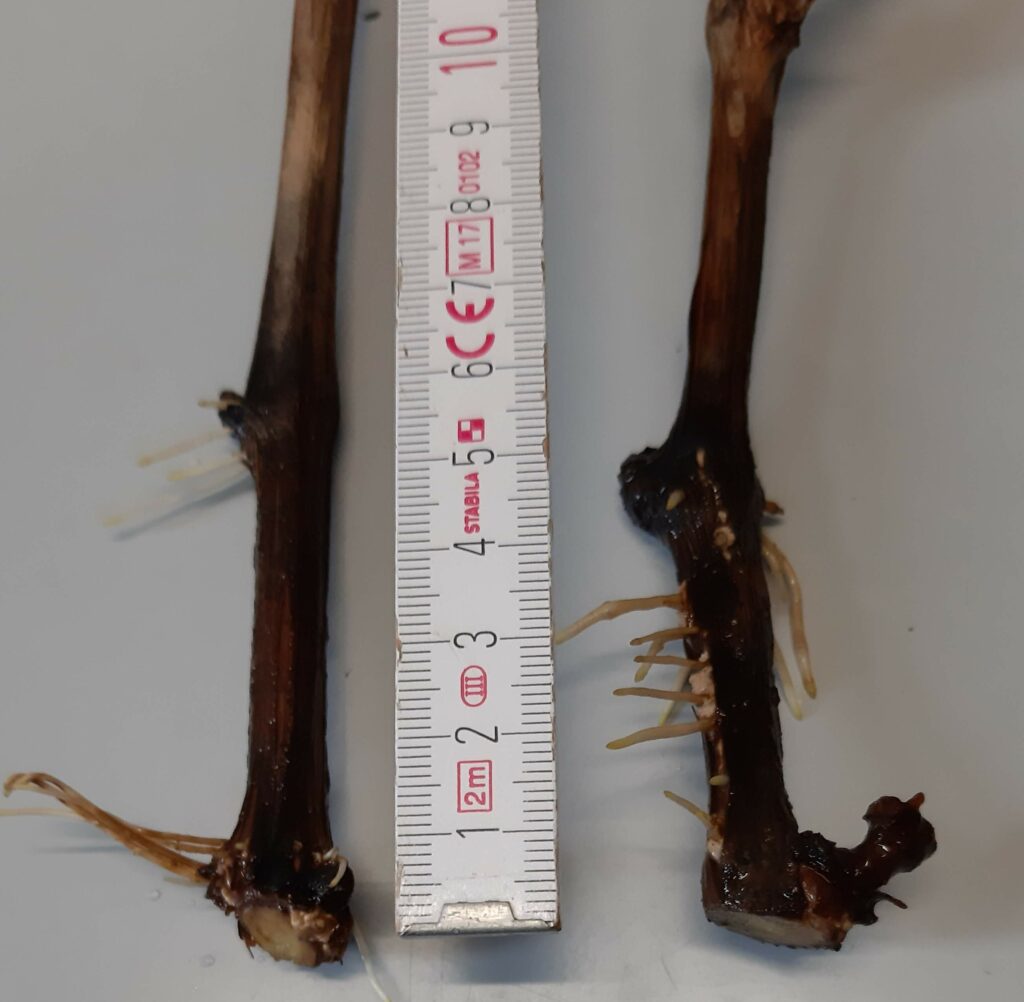
Abb. 9 Vergleich der Wurzelentwicklung von zwei Stecklingen mit unterschiedlichem Blattknotenabstand.Stecklinge, die Wurzeln gebildet haben, wurden in den Boden eingebracht.
Der Steckling auf der rechten Seite hat einen geringeren Abstand zwischen den Blattknoten und zeigt eine ausgeprägte Wurzelentwicklung im Bereich zwischen den Blattknoten.
Es ist wahrscheinlich, dass andere Faktoren als der Abstand zwischen den Blattknoten einen Einfluss darauf haben, ob die Wurzelentwicklung in dieser Region stattfindet. Vielleicht spielt das Alter des Zweigs eine Rolle… erstes Jahr Wachstum, zweites Jahr oder älter? Oder ist der in Frage stehende Bereich eine Region zwischen zwei aufeinanderfolgenden Wachstumsjahren des Zweigs? Diese Faktoren wurden bei der Entnahme der Stecklinge nicht spezifisch kontrolliert. Das Ziel dieses Versuchs war es, herauszufinden, ob die Stecklinge erfolgreich neue Pflanzen der Weinrebe hervorbringen würden, die in mehreren aufeinanderfolgenden Jahren köstliche Trauben geliefert hat. Die bisherigen Ergebnisse deuten darauf hin, dass die Vermehrung von Rebstöcken durch Stecklinge relativ einfach ist und dass eine Pflanze sehr viel Material für Stecklinge liefert.


Abb. 10 Die Stecklinge aus der Gruppe, die noch im Wasser war und eine Wurzelentwicklung gezeigt hat, wurden in den Boden eingebracht. 12.02.2023
Zu diesem Zeitpunkt ist der Großteil der Stecklinge in den Boden eingebracht worden. Es gibt jedoch eine Reihe von Stecklingen, die noch keine Wurzeln gebildet haben und noch im Wasser stehen. Außerdem wurden die Stecklinge, die in Abb. 9 verglichen wurden, werden zur Beobachtung der weiteren Wurzelentwicklung im Wasser belassen.
14.02.2023
Der Steckling, der von der Gruppe am stärksten gewachsen ist, sollte in einen größeren Behälter umgesiedelt werden. Als die Pflanze aus dem Behälter entfernt wurde, stellte man fest, dass sich die Wurzeln so weit entwickelt hatten, dass der Behälter zu eng wurde (Abb. 11).



Abb. 11 Der am weitesten fortgeschrittene Steckling der Gruppe. 14.02.2022











































